薬機法の改正について(その3)
改正されました薬機法についてのコラム(その3)です。今回は、改正事項として「先駆け審査指定制度」及び「条件付き早期承認制度」の法制化について解説いたします。
1.改正事項の背景
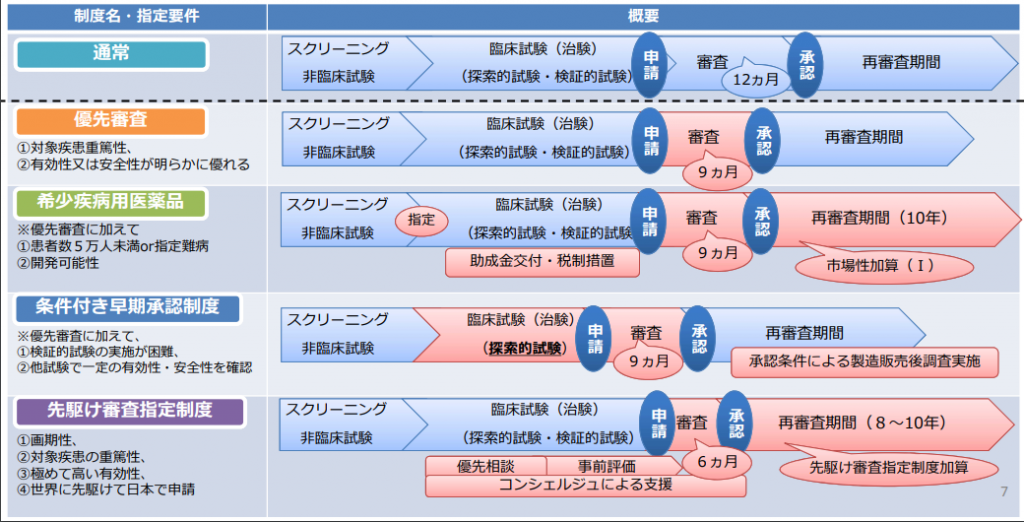
「先駆け審査指定制度」及び「条件付き早期承認制度」は、医薬品等の承認審査に係る優遇措置です。このような優遇措置は、1993年の薬事法改正における希少疾病医薬品、希少疾病医療機器の指定制度の導入以来、拡充されてきました。現行における医薬品等の承認審査に係る優遇制度は以下のようになっています。
医薬品等の承認審査制度に係る優遇措置制度
平成30年度第2回医薬品医療機器制度部会資料より
「先駆け審査指定制度」は、2015年に導入され、世界に先駆けて、革新的医薬品、革新的医療機器等を実用化するため、早期の治験段階で著明な有効性が見込まれる医薬品、医療機器等を指定して、優先的な取扱いにより、承認取得までの期間を短縮し、最先端の医薬品、医療機器を最も早く患者に提供することを目的しています。この制度の対象品目にしてされると、製薬企業等は優先相談、事前評価を受けられるほか、総審査期間を6か月とする優遇措置を受けることができます。
「条件付き早期承認制度」は、2017年に導入され、患者数が少ない等の理由で検証的臨床試験(多数の患者による有効性・安全性の評価試験)の実施が困難なものやその実施に長期間を要する医薬品、医療機器について、製造販売後の有効性・安全性の再確認等を承認条件とすることで早期の実用化を目指すものです。なお、再生医療等製品については、細胞を用い、品質が不均一となり、有効性確認のデータ収集・評価に長時間を要することから2013年より、条件及び期限付き承認制度が導入されています。
優先審査及び希少疾病用医薬品制度は既に法制化されていますが、「先駆け審査指定制度」及び「条件付き早期承認制度」は通知(法律や制度の解釈として示されるもの)として運用されていましたので、法律に基づく制度する必要がありました。新しい制度は次のようになっています。
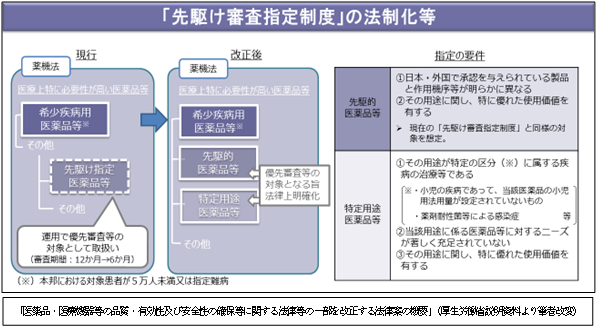
2.「先駆け審査指定制度」の法制化について
現行において通知で運用されている先駆け審査指定制度の試行的実施において対象となっている先駆け指定医薬品等が「先駆的医薬品等」及び「特定用途医薬品等」として区分して指定されます。
「先駆的医薬品等」とは、日本・外国で承認を与えられている医薬品等と作用機序が明らかに異なる医薬品、医療機器等です。また、「特定用途医薬品等」とは、小児用法用量が設定されていない医薬品など、医療用のニーズが高い著しく充足されてない医薬品等です。「先駆的医薬品等」、「特定用途医薬品等」ともに他の医薬品、医療機器等に優先して審査又は調査が行われます。
「特定用途医薬品等」については、試験研究を促進するための必要な資金の確保及び税制上の措置が講じられます。
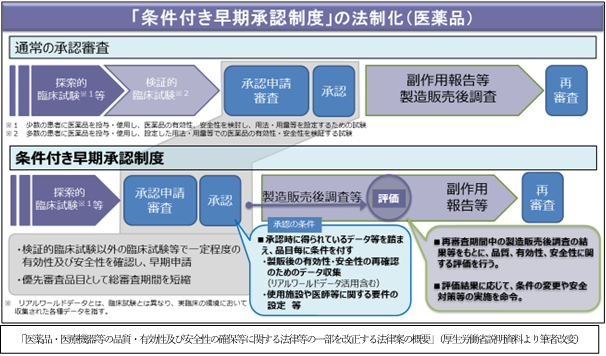
3.「条件付き早期承認制度」の法制化について
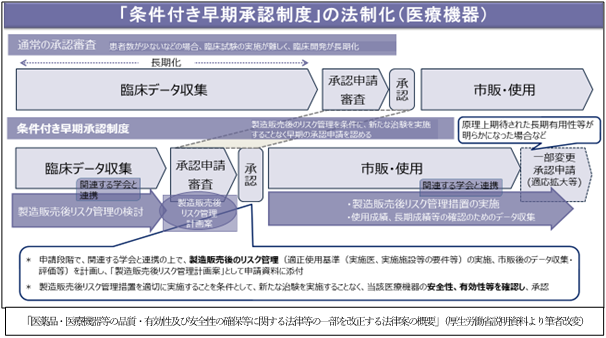
目的は、重篤で有効な治療方法に乏しい疾患について、医療上特に必要性が高い医薬品、医療機器への患者のアクセスの確保を図ることですが、医薬品と医療機器で制度の内容が異なります。
医薬品においては、検証的臨床試験の実施が困難・長期間を要するものについて、一定程度の有効性及び安全性を確認し、承認条件を付すことで承認するものです。その条件として製造販売後の有効性・安全性の再確認のためのデータ収集が課されますが、リアルワールドデータ(実臨床で収集されたデータ)の活用も認めていくこととなっております。リアルワールドデータは実証段階ですが、承認における評価データとなることで医薬品の臨床評価の手法が大きく変わっていくこととなります。その他、使用施設や医師等に関する承認条件も課されます。製造販売後には、承認条件により定められた製造販売後調査等で得られた結果が評価され、評価結果に応じて条件の変更や安全対策等の実施が命じられます。
医療機器においては、患者数が少ない等の理由で新たな臨床試験の実施が困難なものについて、既存の一定の臨床データを評価し、製造販売後のリスク管理措置、市販後のデータ収集・評価をすること等を承認条件として付することで承認するものです。新たな治験を実施しないことで、迅速な承認が期待されます。製造販売後には、承認条件として定められたリスク管理措置の実施が求められます。
以上、今回は「先駆け審査指定制度」及び「条件付き早期承認制度」の法制化について解説いたしました。この法制化は、本年9月からの施行が予定されております。次回以降も、それぞれの改正事項について解説していきます。
文責:岡野内 徳弥
本コラムの無断転載を禁止いたします。

岡野内 徳弥(株式会社CDIメディカル 主査)
静岡県立大学大学院薬学研究科修了、マサチューセッツ大学ビジネススクール修了。
博士(薬学)、経営学修士。
厚生労働省、独立行政法人国立病院機構、独立行政法人医薬品医療機器総合機構、国立医薬品食品衛生研究所、環境省、法務省、神奈川県を経て、現在に至る。